모유 중 내분비계 장애 물질 노출과 생활습관과의 연관성
Association between Exposure to Endocrine Disrupting Chemicals in Breast Milk and Maternal Lifestyle Factor
Article information
Trans Abstract
This study aimed to investigate the concentrations of nonpersistent endocrine-disrupting chemicals (EDCs) and per- and polyfluoroalkyl substances (PFAS) in human milk through a literature review and to affirm the association between EDCs and lifestyle factors based on the reviewed literature. We analyzed studies reporting EDC concentrations in breast milk from literature published on Google Scholar and PubMed between 2000 and 2022. In Korea, most EDC concentrations in breast milk were comparable to or lower than those in other countries. However, the concentrations of PFAS in breast milk, especially perfluorooctanoic acid, have shown an increasing trend compared to the past in Korea. Considering the potential risks of EDCs, breastfeeding mothers should take measures to minimize their exposure to these chemicals.
서 론
내분비계 장애 물질(endocrine disrupting chemicals, EDCs)은 호르몬의 생산, 방출 및 수송 등의 호르몬 작용을 방해하는 외인성 화합물 또는 그 혼합물을 의미하며, 식품, 화장품, 개인위생용품(personal care products), 생활용품, 의약품 등을 통해 일상생활에서 쉽게 노출될 수 있다(Di Napoli et al., 2021; Martin et al., 2022). 내분비계 장애 물질은 잔류 기간에 따라 반감기가 6-48시간 정도로 짧아 대사를 통해 대부분 소변으로 배출되는 비지속성 내분비계 장애 물질(nonpersistent EDCs)과 반감기가 최소 1년에서 10년 이상으로 몸에 잔류하는 기간이 길어 여러 가지 건강영향을 나타내는 잔류성 유기오염물질(persistent organic pollutants, POPs)로 구분할 수 있다. 일상속에서 노출되는 대부분의 phthalate류, bisphenol류, paraben 류가 비지속성 내분비계 장애 물질에 해당되며, 과불화화합물(per- and polyfluoroalkyl substances, PFASs), 난연제, 다이옥신류 등이 잔류성 유기오염물질(POPs)에 해당된다(Hallberg et al., 2023; Kim et al., 2020a).
임신출산기는 임산부의 호흡량 및 심박출량 증가와 같은 생리적 특성으로 인해 내분비계 장애 물질에 취약한 시기로서, 이 시기에 임산부가 내분비계 장애 물질에 노출되면 태반을 통해 태아에게 전달되거나 모유수유를 통해 신생아에게 전달될 수 있다(Di Napoli et al., 2021). 한국, 프랑스, 독일 등에서 발표된 연구 결과에 따르면 산전 내분비계 장애 물질 노출은 저체중아 출생과 신생아 머리 둘레를 감소시켰고(Chang et al., 2019), 영유아의 비만, 내당능 장애 및 각종 암 발생 등의 위험성을 증가시켰으며(Kahn et al., 2020), 인지발달저하, 주의력결핍 과다행동장애(attention deficit hyperactivity disorder)와 같은 신경학적 발달에 부정적인 영향을 미쳤다(Kim et al., 2023a).
따라서, 이 연구는 모유 중 비지속성 내분비계 장애 물질과 대표적인 잔류성 유기오염물질인 과불화합물의 농도에 대한 국내외 문헌 고찰을 통해 한국 모유의 오염실태 및 생활습관과의 연관성에 살펴보고자 한다.
본 론
1. 문헌검색 및 고찰
2000년 이후부터 2022년까지 Google Scholar 및 PubMed 에 보고된 국내외 문헌 중 모유 중 내분비계 장애 물질의 농도를 보고한 연구를 조사하였다. 문헌검색을 위한 키워드로 ‘프탈레이트’, ‘phthalate’, ‘phthalate metabolites’, ‘MEP, MnBP, MiBP, MBzP, MiNP, MEHP’, ‘프탈레이트 대체가소제’, ‘비스페놀’, ‘Bisphenol’, ‘BPA’, ‘과불화화합물’, ‘poly-and perfluo-rinated compounds’, ‘PFOA’, ‘PFOS’ 등을 이용하여 검색하였다. 최종적으로 총 42편의 문헌이 검색되었으며, 각 물질별로는 프탈레이트류 15편, 비스페놀류 중 bisphenol A (BPA)가 20편, 과불화화합물이 10편이었다. 대상 논문은 출판된 원문만 포함하였으며, 초록만 공개되거나 Proceeding 논문들은 제외하였다. 프탈레이트는 프탈레이트 대사체 중 monoethyl phthalate (MEP), mono-n-butyl phthalate (MnBP), mono-isobutyl phthalate (MiBP), mono-benzyl phthalate (MBzP), mono-isononyl phthalate (MiNP), mono-2-ethylhexyl phthalate (MEHP)를 조사하였고, 비스페놀류는 BPA를, 과불화화합물은 perfluorooctanoic acid (PFOA), perfluorooctane sulfonic acid (PFOS)를 조사하였다.
문헌고찰은 저자(연도), 국가, 샘플 수집 기간, 대상자 수, 물질별(프탈레이트류, BPA, 과불화화합물) 중위수 농도에 대하여 분석 후 각각 표로 제시하여 비교하였으며, 가장 최근 보고된 국내 연구인 Kim 등(2020a)의 연구를 중심으로 국내외 연구 결과와 비교하여 기술하였다.
2. 모유 중 비지속성 내분비계 장애 물질 농도
대부분의 비지속성 내분비계 장애 물질들은 간에서의 대사와 신장 배설기능을 통해 쉽게 가수분해(hydrolyzed), 산화(oxi dized), 글루크론화(glucuronidated), 술폰화(sulfornated)되어 주로 소변을 통해 배설되기 때문에, 모유 중의 농도는 소변보다 높지 않다.
국내외 문헌 중 모유 중 프탈레이트 농도를 보고한 연구는 총 15편이었으며, 국내 4편, 유럽 7편, 아시아 3편, 북아메리카(캐나다) 1편이었다(Table 1). 모유 중 MEP 농도의 중앙값(median value)은 0.28-0.40 µ g/L 범위로 검출되었으며, 국외의 경우 0.25-0.97 µ g/L의 범위로 보고되었다. MEP는 캐나다를 제외하고는 국내 모유 샘플의 농도가 가장 낮은 것으로 나 타났다. MnBP의 농도는 국내연구의 경우 0.89-1.70 μg/L, 국 외의 경우 0.66-12.0 μg/L이었으며, 핀란드에서 가장 높게 검 출되었다. MiBP는 국내연구에서 0.49-0.60 μg/L, 국외에서 는 0.30-18.80 μg/L으로 검출되었으며, 아시아 국가에 비해 유 럽에서 더 높게 검출되었다. 또한, MBzP는 국내연구에서 0.19 μg/L, 국외에서는 0.10-1.30 μg/L로 검출되었으며, 마찬가지 로 유럽이 다른 국가에 비해 더 높았다. MiNP는 국내 연구에 서 0.08 μg/L, 국외에서 0.65-101.0 μg/L로 검출되었으며, 특 히 덴마크와 독일이 101.0 μg/L으로 가장 높게 검출되었다. MEHP는 12개 연구 모두에서 검출된 물질이었으며, 국내연구 에서 1.72-2.50 μg/L, 국외연구에서는 0.30-16.19 μg/L 범위 로 검출되었다(Fig. 1). 결과적으로, 국내의 모유 중 프탈레이트 농도는 해외와 비슷하거나 낮은 수준이었다.
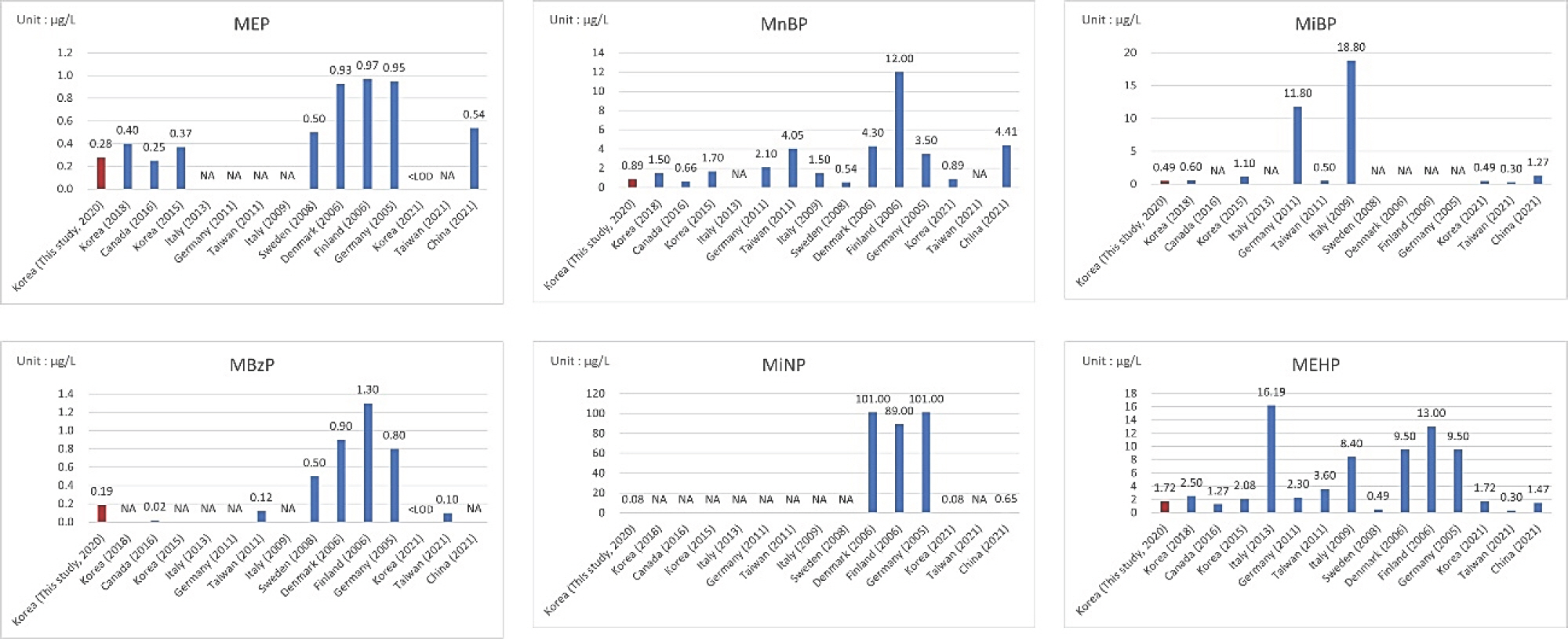
Phthalates concentration in breast milk. This bar graph illustrates the median concentration values (μg/L) of phthalate metabolites in breast milk. NA, not available; MEP, monoethyl phthalate; MnBP, mono-n-butyl phthalate; MiBP, mono-isobutyl phthalate; MBzP, mono-benzyl phthalate; MiNP, mono-isononyl phthalate; MEHP, mono-2-ethylhexyl phthalate.
모유 중 BPA 농도에 대한 국내외 데이터 비교는 Table 2와같다. 조사된 문헌은 총 20편이었으며, 국내 연구 4편, 유럽 6편, 북아메리카 6편, 아시아 4편이었다. 모유 중 BPA 농도의 중앙값(median value)은 국내 연구에서 0.25-0.80 µ g/L 범위로검출되었으며, 일본에서 진행된 연구에서는 0.61 µ g/L, 중국에서 진행된 2개의 연구에서는 0.13-0.21 µ g/L로 국내와 비슷하였다. 미국에서 진행된 3개의 연구에서는 중간 농도의 범위가0.68-6.5 µ g/L로 국내보다 더 높게 나타났다(Fig. 2). 결과적으로, 국내의 모유 중 BPA 농도는 해외와 비슷하거나 낮은 수준이었다.
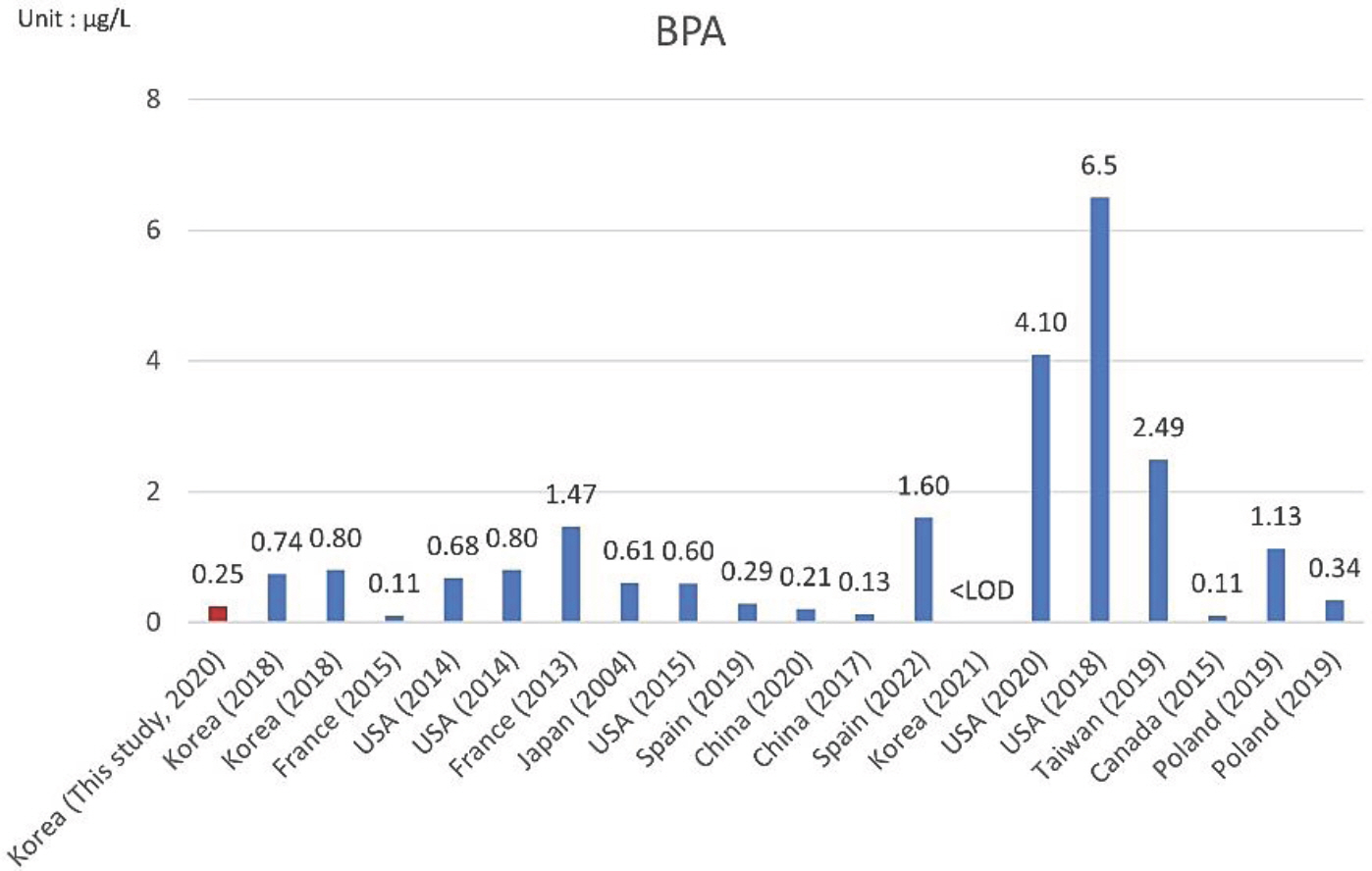
Bisphenol A (BPA) concentration in breast milk. The bar graph illustrates the median value(μg/L) of BPA in breast milk.
프탈레이트와 BPA는 바닥재에서부터 식품까지 다양한 제품에서 발견되는 내분비계 장애 물질이다. 신생아 용품이나 육아용품에 경우, 최근 들어 국가에서 프탈레이트 허용 농도를 제한하고 있어 직접적인 노출이 감소하고 있지만 식품, 먼지를 통한 흡입, 피부 흡수 그리고 모유를 통한 노출은 생활습관에 따라 완전하게 배제되기 힘든 잠재적 노출원이다(Arbuckle et al., 2016). 비지속성 내분비계 장애 물질은 소량이라도 모유를 통해 지속적으로 섭취될 경우, 신생아 발달 지연이나 소아 비만 등으로 이어질 위험이 있다(Chang et al., 2019; Deng et al., 2021) 특히, 유럽에 비해 한국에서 비교적 높게 검출된 MnBP 의 경우, 노출이 증가할수록 영유아 발달점수 및 신경인지 동작점수가 유의하게 감소한다고 연구된 바 있다. MnBP는 주로 가습기 및 카펫 사용, 도로 먼지, 페인트 접촉 등을 통해 노출되는데, 해당 노출원 모두 대부분을 실내에서 시간을 보내는 임산부의 주거 및 생활환경에서 어렵지 않게 찾아볼 수 있다(Deng et al., 2021; Lin et al., 2011).
3. 모유 중 과불화화합물 농도와 경시변화
과불화화합물 대표적인 중 PFOS, PFOA은 국내 모유에서 100% 발견되었으며, 평균 농도는 0.058 및 0.114 ng/mL였다. 그 외 perfluorobutane sulfonate와 perfluorodecane sulfonate 는 모유 중 어떤 샘플에서도 발견되지 않았으며, perfluoropentanoic acid, perfluo roheptanoic acid, perfluorododecanoic acid 및 perfluorote tradecanoic acid는 단지 몇 개의 모유샘플에서만 발견되었다(range, 0.5%-7.25%). 국내 모유 중 PFOS의 중간 농도는 0.050 ng/mL였으며, 이는 캐나다, 미국, 아일랜드, 체코, 스웨덴보다는 높은 수준이었으며(Abdallah et al., 2020; Awad et al., 2020; Černá et al., 2020; Jin et al., 2020a; Zheng et al., 2021), 스페인보다는 낮은 수준이었다(Beser et al., 2019) (Table 3, Fig. 3). 모유 중 PFOA의 중간 농도는 0.1 ng/mL였으며, 이는 중국, 미국, 체코, 스웨덴보다 높은 수준이었다(Table 3, Fig. 3). 전체적으로 한국의 모유 중 과불화합물의 농도는 다른 나라보다 높다는 것을 알 수 있다. 특히, PFOA의 경우, 2007년에 조사된 결과에 비해 2018년 수집된 최근 연구 결과에 의하면, 모유 중 PFOA의 농도가 12년만에 약 3배(278%) 증가하였다(Fig. 3) (Kang et al., 2016; Kim et al., 2011; Lee et al., 2018b). 이는 전 세계의 모유 중 PFOS와 PFOA의 농도가 감소 추세인 것을 볼 때, 우려되는 결과이다. 중국의 한 연구에 의하면 1996년에 비해 2019년 모유 중 PFOS와 PFOA의 농도는 각각 37%, 19% 감소하였다고 보고된 바 있고, 미국의 한 연구에서도 2004년에 비해 2019년 모유 중 PFOS와 PFOA의 농도가 각각 71%, 56% 감소하였다고 보고한 바 있다(Tao et al., 2008; Zheng et al., 2021). 과불화화합물의 모유로의 이동은 혈청단백질과의 결합을 통해 유선막으로 전달되고, 이 결합은 혈청 알부민, 지방산 결합, 단백질 및 티레틴(thyretin)과 같은 단백질 친화성에 의해 조절되는데, 이때 이 조절의 효율성은 과불화화물의 농도에 따라 달라진다고 알려져 있다(Chen et al., 2017a, 2017b; Kim et al., 2023b; Zheng et al., 2021). 최근 역학연구에 의하면, PFOA의 노출은 콜레스테롤과 저밀도 지질단백질 (low-density lipoprotein)의 증가와 연관성이 있고, 출생체중 저하, 조산, 신경학적 발달과 관련이 있었다(Averina et al., 2021; Bach et al., 2015; Carrizosa et al., 2021; Harris et al., 2021; Mora et al., 2018; Steenland et al., 2018; Stone et al., 2021; Zeng et al., 2015). 따라서 산모그룹에 대한 모유 중 과불화화합물 농도의 지속적인 모니터링이 필요하다.
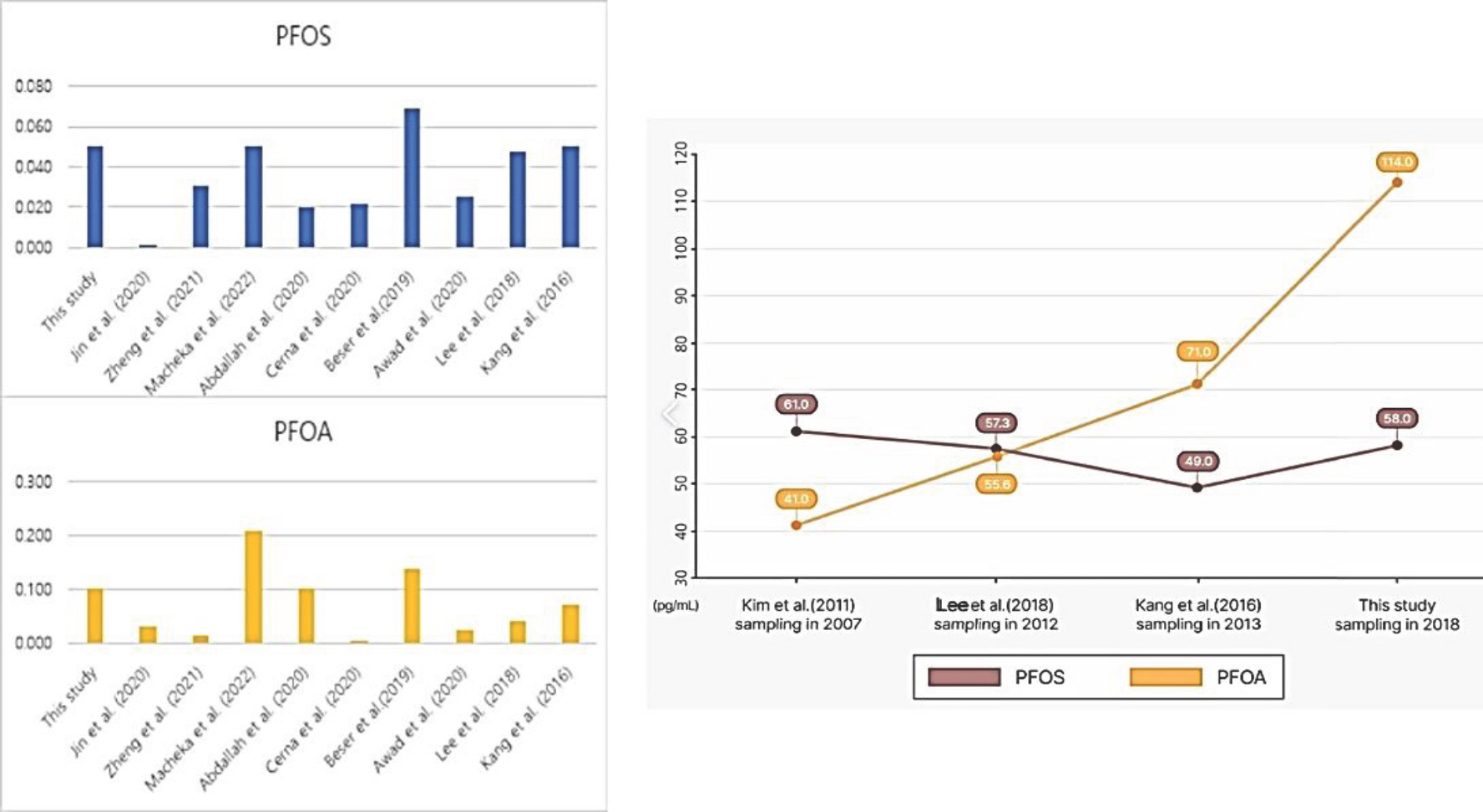
Concentrations and time trend of per- and polyfluoroalkyl substances (PFAS) in breast milk. This graph illustrates the concentration and changes in the mean levels of perfluorooctanesulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) in the breast milk of Korean mothers from 2007 to 2018 (pg/mL). PFOS, perfluorooctane sulfonic acid; PFOA, perfluorooctanoic acid. Adapted from Kim et al. Chemosphere 2023b;310:136688.
4. 모유를 통한 내분비계 장애 물질의 하루 섭취량과 허용 가능섭취량
모유를 통해 신생아가 하루에 섭취하는 내분비계 장애 물질(프탈레이트류, 비스페놀류)의 농도를 계산하기 위하여 노출평가에 사용되는 다음과 같은 공식이 사용되었다. 위험수준평가를 위해 신생아의 내분비계 장애 물질 섭취량(estimated daily intake, EDI)을 미국 환경부(U.S. Environmental Protection Agency), 유럽식품안전청(European Food Safety Authority, EFSA), 세계보건기구(World Health Organization, WHO), 한국 식품의약품안전처(Korea Ministry of Food and Drug Safety)에 의해 인용되는 하루 허용가능한 섭취량(tolerable daily intake, TDI) 수치와 비교하였다.
국내에서 진행된 모유를 통한 내분비계 장애 물질의 하루섭취량을 조사한 국내 연구는 Kim 등(2020a, 2023b)의 연구였으며, 이 연구들에 의하면, MEP, MnBP, MiBP, MBzP, MEHP, MiNP의 하루섭취량의 중간 농도는 3.48 (0.10-9.07), 0.21 (0.02-2.88), 1.32 (0.10-9.84), 0.04 (0.01-0.13), 0.62 (0.10-102.87) 및 0.02 (0.00-0.56) μ g/kg bw/day였다(Kim et al., 2020a). Kim 등(2020a)의 연구에서 EDI를 국내외 TDI 수치와 비교한 결과, 3개의 대상자에서 MEHP와 DiBP의 EDI가 TDI 수준을 초과하였다. 과불화화합물인 PFHxS, PFOS, PFHxA, PFOA, PFNA, PFDA, Σ PFSA, Σ PFCA, 총 PFASs의 mean (standard deviation) 하루 섭취량은 0.89 (1.51), 0.81 (0.74), 0.65 (0.77), 1.57 (1.92), 0.13 (0.25), 0.11 (0.11), 1.69 (1.97), 2.32 (1.30), 및 3.87 (2.29) μ g/kg bw/day였으며, 국내외 TDI 수치를 상회한 수치는 없었다(Kim et al., 2023b).
5. 모유 중 내분비계 장애 물질 농도와 생활습관의 연관성
Kim 등(2020a, 2023a)의 연구 결과에 의하면, 모유 중 높은 프탈레이트 농도는 식이 중 잦은 생선섭취와 관련이 있었으며(Bai et al., 2015; Serrano et al., 2014), 모유 중 높은 과불화화합물 농도는 생선, 아이스크림, 캔 음식 등의 잦은 섭취와도 연관성이 있었다(Christensen et al., 2016; Denys et al., 2014; Fair et al., 2019; Fernandes et al., 2018; Haug et al., 2010; Kim et al., 2023b; Lee et al., 2018b; Liu et al., 2022; Sadia et al., 2020). EFSA 역시 생선, 해산물 섭취가 PFOS 노출의 가장 큰 기여 요인이라고 하였으며, 유럽식품안전청 패널(EFSA Panel on Con taminants in the Food Chain [EFSA CONTAM Panel] et al., 2018, 2020)과 미국 국민건강영양조사(US National Health and Nutrition Examination Survey)에서도 최근 30일안에 생선을 섭취한 경우, 혈청 중 PFOS, PFNA, PFDA, perfluoroun decanoic acid의 증가와 관련이 있다고 보고한 바 있다(Christensen et al., 2016; Jain, 2014). 개인위생용품 사용과 모유 중 높은 프탈레이트 및 BPA농도는 플라스틱 및 일회용 식기 사용, 방향제 사용, 메이크업용품 사용, 새 가구 사용 등과 연관성이 높았다(Fisher et al., 2017; Hines et al., 2015; Kim et al., 2020a; Larsson et al., 2014; Snoj Tratnik et al.,2019). 또한, 중강도 이상의 운동은 체내 내분비계 장애 물질 중 일부를 땀을 통해 배출시킴으로써 모유 중 내분비계 장애 물질 농도를 낮출 수 있다(Genuis et al., 2012; Kim et al., 2020a; Lee et al., 2018b; Wenzel et al., 2018).
결 론
모유는 WHO가 권장하는 엄마와 영유아에게 필요한 영양소를 갖추고 있는 식품이다. 국내외 모유 중 대부분의 내분비계 장애 물질의 농도는 국외에 비해 비교적 비슷하거나 낮은 수준이었으나, 대표적인 POPs물질인 과불화합물은 과거보다 모유 중 농도가 증가 추세이므로 계속적인 관리와 관찰이 필요하다.
국내 모유 중 내분비계 장애 물질의 하루섭취량의 경우, 지금까지 국내외 연구에서 보고된 허용수준보다 낮은 수준이나 내분비계 장애 물질의 잠재적 위험성을 생각할 때, 모유수유 중인 산모는 내분비계 장애 물질이 포함된 물질의 노출을 피하려고 노력하는 행동이 필요하다.
산모가 실천할 수 있는 노출 저감 방안의 예로는 플라스틱 등의 1회 용품 사용량을 줄이고 부득이하게 1회 용품을 사용해야 하는 경우라면 직접 가열하거나 재사용하는 것을 자제해야 한다. 환기를 통해 실내 내분비계 장애 물질 흡입을 최소화하고 잦은 손 씻기를 통해 피부 흡수 및 섭취를 통한 유해 물질 노출을 줄일 수 있다(Kim et al., 2023a). 가장 높은 비율을 차지하는 식품을 통한 내분비계 장애 물질 섭취를 줄이는 대표적인 방안으로는 배달음식, 통조림 캔 및 패스트푸드 섭취를 중지하는 것이 있는데, 이는 임산부의 BPA 노출을 획기적으로 줄여주는 효과가 있었다(Kim et al., 2020b).
더 나아가 국가 및 기관 수준에서는 산모의 내분비계 장애 물질 노출 정도와 건강 영향을 확인할 수 있는 국가 수준의 코호트 연구가 필요하며, 저감을 위해 환경 친화적인 정책과 법률을 강화해야 하며, 친환경적인 기술 개발과 환경 연구를 위해 지속적인 투자를 지원해야 한다. 또한, 장기적으로 환경보건 분야에서는 산모를 포함한 환경 취약계층을 대상으로 환경건강 이해력을 증진시키기 위한 적극적인 교육 프로그램을 연구 및 적용시켜야 할 것이다.
Notes
저자들은 이 논문과 관련하여 이해관계의 충돌이 없음을 명시합니다.
감사의 글(ACKNOWLEDGMENTS)
이 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. NRF2021R1A2C4001 788).



